产地国家:日本
处方药:是
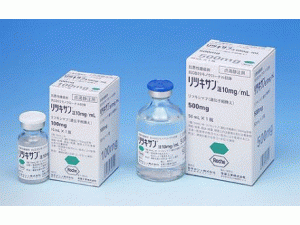
所属类别:500毫克/10毫升(10毫升)/瓶
包装规格:500毫克/10毫升(10毫升)/瓶
计价单位:瓶
生产厂家英文名:Chugai Pharmaceutical Co.
原产地英文商品名:RITUXAN Injection(リツキサン注)500mg/mL(10mL)/Vial
原产地英文药品名:Rituximab(genetical recombination)
中文参考商品译名:RITUXAN(リツキサン注)500毫克/10毫升(10毫升)/瓶
中文参考药品译名:利妥昔单抗基因重组
简介
部份中文利妥昔单抗处方资料(仅供参考)
商品名:RITUXAN
英文名:Rituximab
中文名:利妥昔单抗基因重组注射剂
生产商:中外制药リツキサン点滴静注100mg/リツキサン点滴静注500mg
药物类别名称:抗CD20单克隆抗体
批准日期:2018年6月
欧文商标名:Rituxan Intravenous Infusion
一般名:リツキシマブ (遺伝子組換え)Rituximab (Genetical Recombination) (JAN)
本质:一种单克隆抗体,与存在于人类B淋巴细胞表面的分化抗原CD20结合(磷蛋白),CD20抗原(可变区域)的识别位点由小鼠衍生,其他部分(常量区域)为人类起源(IgG1+)小鼠-人类嵌合抗体由1,328个氨基酸组成。
分子量:144,510 Da
批准条件 1. 制定药品风险管理计划并适当实施。 2.CD20阳性B细胞非霍奇金淋巴瘤对于使用结果调查,根据提交的商业后调查计划大纲,及时汇总调查结果并一起提交。 3. 可折射肾病肾病综合征(频繁复发或类固醇依赖)由于日本的临床试验病例数量极为有限,在生产和销售后,通过对所有病例进行使用性能调查,以及掌握使用这种药物的患者的背景信息,在积累与一定数量的病例相关的数据之前, 我们会在早期收集有关该药物的安全及效力的数据,并采取必要措施,以正确使用该药物。 4.抑制ABO血型不合格肾移植和肝移植中抗体相关排斥对于ABO血型不合格肝移植,由于在日本使用的经验极其有限,在生产和销售后,通过对所有病例进行使用性能调查,直到积累与一定数量的病例相关的数据, 除了掌握使用该药物的患者的背景资料外,我们会及早收集该药物的安全及疗效资料,并采取必要措施正确使用药物。
药用药理学:1CD20抗原人类CD20抗原,Pro-B细胞,一种分化抗原表达在几乎所有正常和肿瘤的B淋巴细胞,除了血浆细胞(磷蛋白),细胞以外的B淋巴细胞不表达。
药理作用 (1) 体外CD20抗原特异性结合作用IDEC-2B8(小鼠型CD20单克隆抗体具有与利妥昔单抗(可变区域)相同的CD20抗原识别位点,抑制与人CD20抗原的粘合,B1是现有的抗CD20抗体密度依赖方式,IC50 50%抑制浓度)值B1,和1/2至1/3的Leu16(抗人CD20抗体),表现出对人CD20抗原有很强的抗原特异性结合能力。这种具有很强的抗原特异性结合能力,该制剂(小鼠-人嵌抗体)得以维持。 (2) 体外B淋巴细胞特异性结合这种制剂特别结合人外周血B淋巴细胞和人类低恶性B淋巴瘤细胞,没有与其他免疫系统细胞发生反应。 (3) 体内B淋巴细胞损伤由于每周静脉注射一次,每天4周和4天,在囊虫猴,外周血,骨髓和淋巴结的B淋巴细胞明显减少。另外,T淋巴细胞没有显示任何变化。 (4)与人体正常组织的交叉反应由于检查与成人正常组织冷冻部分的交叉反应,该制剂显示反应性、淋巴结、骨髓、外周血细胞、扁桃体,只有脾脏、非淋巴组织没有反应。
作用机制 (1)补充依赖性细胞毒性(补充依赖性细胞毒性,CDC)该制剂在人补充的情况下溶解50%的SB细胞(人源CD20阳性细胞),浓度为2.2μg/mL,汇丰细胞(人源CD20阴性细胞)不溶解,它被证实对具有CD20抗原的细胞具有补充依赖性细胞毒性作用。人补充的存在,不影响造血干细胞(CD34阳性细胞)的菌群形成能力。 (2)抗体依赖细胞介导细胞毒性,ADCC该制剂在存在人体效应细胞的情况下,溶解50%的SB细胞,浓度为3.9μg/mL,汇丰细胞不溶解,抗体依赖细胞介导细胞毒性作用对具有CD20抗原的细胞有CD20抗原,经确认有。
适应症:阳性B细胞非霍奇金淋巴瘤:差别化集群○CD20阳性慢性淋巴性白血病○免疫抑制条件下CD20阳性的B细胞淋巴增殖性疾病○多血管炎肉芽肿,显微多发性血管炎折射肾病综合征(频繁复发或类固醇依赖)慢性特发性血小板减少紫杉醇○以下abo血型不达标移植中抗体相关排斥的抑制肾脏移植,肝脏移植:钠(111In)ibritumumabth 奇沃克桑 (转基因)注射和ytrium(90Y) ibritumumthchioxatan(转基因)注射预管理。
